Bienvenidos a mi blog
HIBRIDACION DEL CARBONO
TEORIA DE LA HIBRIDACION DEL CARBONO
La hibridación del carbono implica la combinación de dos orbitales atómicos puros para formar un nuevo orbital molecular “híbrido” con características propias.
para describir la hibridación del carbono debe tomarse en cuenta que las características de cada orbital (su forma, energía, tamaño, etc.) dependen de la configuración electrónica que tenga cada átomo.
Es decir, las características de cada orbital dependen de la disposición de los electrones en cada “capa” o nivel: desde el más cercano al núcleo hasta el má
s externo, conocido también como capa de valencia.
Los electrones del nivel más externo son los únicos disponibles para formar un enlace. Por lo tanto, cuando se forma un enlace químico entre dos átomos se genera el solapamiento o superposición de dos orbitales (uno de cada átomo) y esto está estrechamente relacionado con la geometría de las moléculas.
Tipos de hibridación
Hibridación tipo sp3
La hibridación sp3 consiste en la formación de cuatro orbitales “híbridos” a partir de los orbitales 2s, 2px, 2py y 2pz puros.Así, se tiene el rearreglo de los electrones en el nivel 2, donde existen cuatro electrones disponibles para la formación de cuatro enlaces y se ordenan de forma paralela para tener menor energía (mayor estabilidad).
Un ejemplo es la molécula de etileno (C2H4), cuyos enlaces forman ángulos de 120° entre los átomos y le proporcionan una geometría trigonal plana.
En este caso se generan enlaces simples C-H y C-C (debido a los orbitales sp2) y un enlace doble C-C (debido al orbital p), para formar la molécula más estable.
Hibridación de tipo sp2
A través de la hibridación sp2 se generan
tres orbitales “híbridos” a partir del orbital 2s puro y tres orbitales 2p puros. Además, se obtiene un orbital p puro que participa en la formación de un enlace doble (llamado pi: “π”).
Un ejemplo es la molécula de etileno (C2H4), cuyos enlaces forman ángulos de 120° entre los átomos y le proporcionan una geometría trigonal plana. En este caso se generan enlaces simples C-H y C-C (
debido a los orbitales sp2) y un enlace doble C-C (debido al orbital p), para formar la molécula más estable.
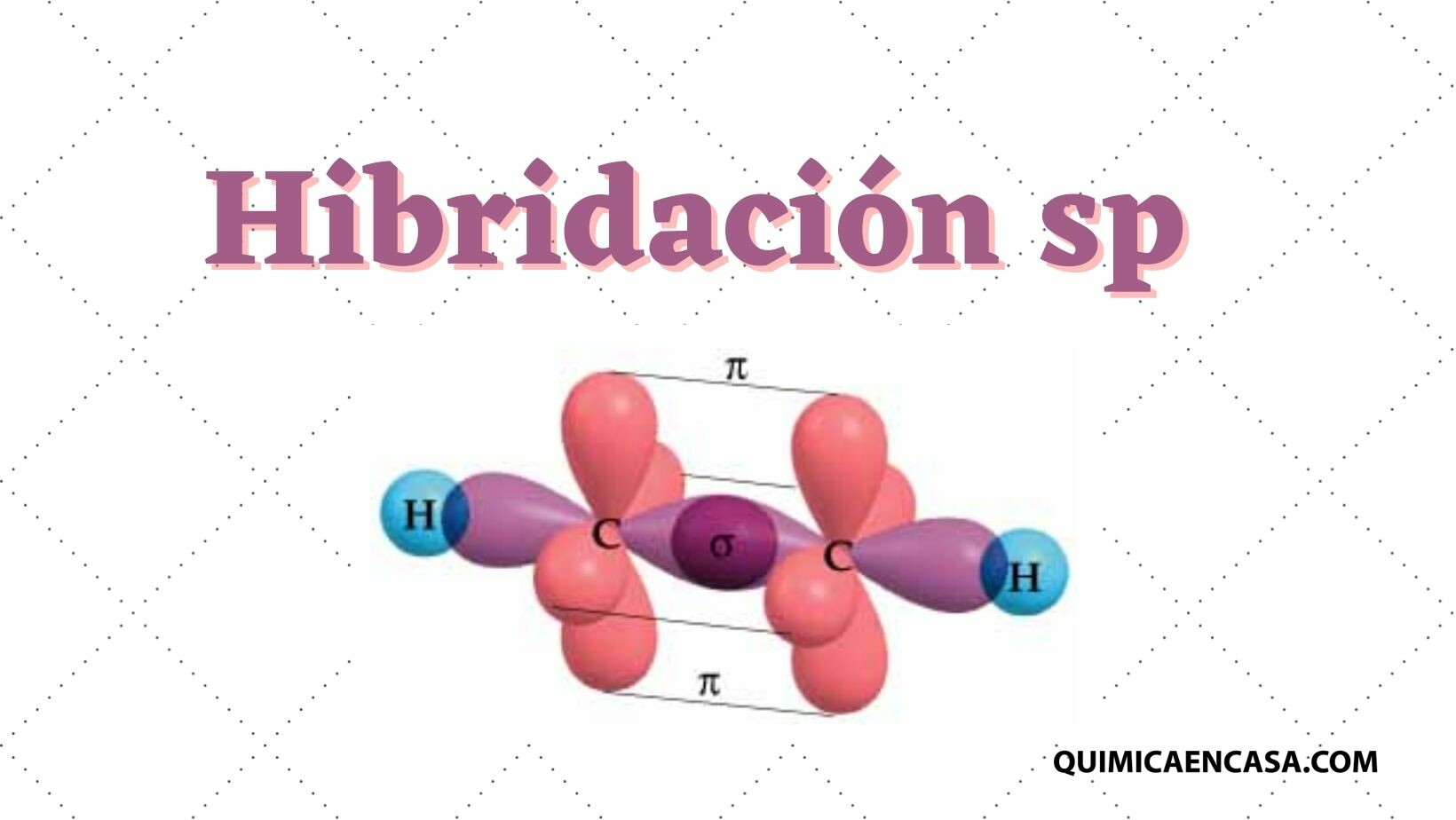
Hibridación de tipo sp
Mediante la hibridación sp se establecen dos orbitales “híbridos” a partir del orbital 2s puro y tres orbitales 2p puros. De esta manera se forman dos orbitales p puros que participan en la formación de un enlace triple.
Para este tipo de hibridación se presenta como ejemplo la molécula de acetileno (C2H2), cuyos enlaces forman ángulos de 180° entre los átomos y le proporcionan una geometría lineal.
Para esta estructura se tienen enlaces simples C-H y C-C (d

Comentarios
Publicar un comentario